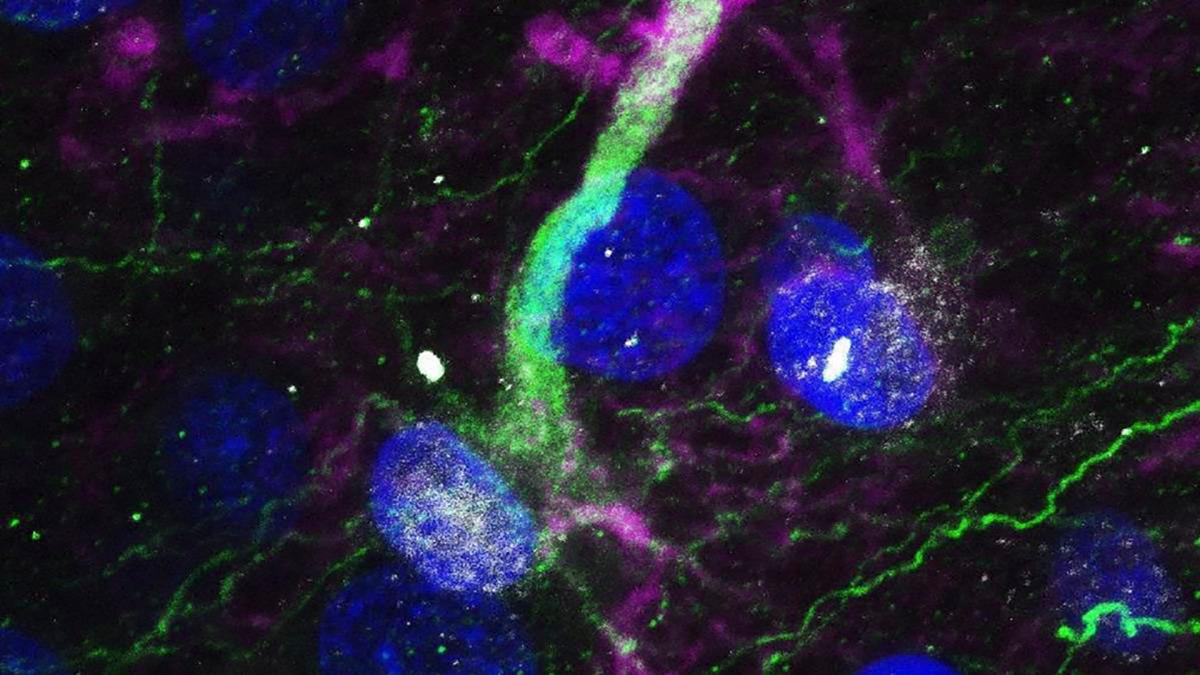
Investigadores del Conicet en la Fundación Instituto Leloir (FIL) lograron identificar que una molécula (TNF) es la responsable de la muerte de las células que se trasplantan al cerebro en tratamientos experimentales contra la enfermedad de Parkinson, por lo que su inhibición podría mejorar la eficacia de estas terapéuticas que hoy son una de las principales apuestas para revertir los efectos de la patología.
El trabajo, que fue publicado recientemente en la revista científica Plos One, logró identificar que “el trasplante celular genera inflamación, que ésta dura bastante tiempo y que hay específicamente una molécula inflamatoria, que se llama TNF (factor de necrosis tumoral alfa), es la que produce la muerte de las neuronas trasplantadas”, explicó a Télam Fernando Pitossi, jefe del Laboratorio de Terapias Regenerativas y Protectoras del Sistema Nervioso Central de la FIL y uno de los autores del artículo.
“Hay tres ensayos clínicos con neuronas que se obtienen en el laboratorio a partir de un tipo de células madre, que se llama células madre pluripotentes”Fernando Pitossi, jefe del Laboratorio de Terapias Regenerativas
“En la actualidad hay terapias farmacológicas, o sea, con medicamentos; hay terapias quirúrgicas como por ejemplo cuando se trasplanta un electrodo, y lo que se está probando ahora son terapias celulares, en las que hay mucha expectativa”, explicó Pitossi.
Y continuó: “Estas terapias celulares consisten en trasplantar (inyectar) un tipo de neuronas derivadas de células madre que liberan dopamina (llamadas precursoras neuronales dopaminérgicas o DA-CM) en el cerebro y están en fase experimental. Hay tres ensayos clínicos en este momento con estas neuronas que se obtienen en el laboratorio a partir de un tipo de células madre, que se llama células madre pluripotentes, que es con las que trabajamos nosotros en nuestro laboratorio”.
Parkinson
La enfermedad de Parkinson es un trastorno neurológico progresivo cuyos síntomas motores se producen principalmente por la muerte de las neuronas dopaminérgicas de una zona del cerebro; los tratamientos actuales no detienen su avance ni permiten reestablecer el funcionamiento de lo que se ha perdido.
Pitossi detalló que lo que hicieron en el laboratorio fue, en principio, generar esas células para inyectar que generan dopamina a partir de células madres pluripotentes.
“Después quisimos contestar una pregunta clave para la eficacia del tratamiento que es la siguiente: en los trasplantes que se están realizando el 90% de las células inyectadas mueren, ¿por qué? La hipótesis que teníamos fue que esto sucedía por la inflamación que se produce en el cerebro pos trasplante”, detalló el investigador.
“Nosotros siempre vemos la investigación como una inversión no como un gasto”Fernando Pitossi, jefe del Laboratorio de Terapias Regenerativas
Tras la investigación, el equipo confirmó que “después de trasplantar las neuronas en cerebros animales hay inflamación y la inflamación dura bastante tiempo; luego corroboramos in vitro con las células solas que la inflamación mata las neuronas dopaminérgicas y que hay una molécula inflamatoria que se llama TNF (factor de necrosis tumoral alfa) que si uno la inhibe aumenta la vida de las neuronas o sea que esa sería como la molécula que gatilla la muerte de las neuronas que liberan dopamina.
“Si esto se corrobora en otros modelos se podría hacer un tratamiento complementario del trasplante celular para disminuir la inflamación y sobre todo el TNF y así aumentar la sobrevida de las neuronas y aumentar la eficacia del tratamiento“, señaló Pitossi.
Pero alertó que “para que esto llegue a ser de utilidad en los pacientes todavía faltan más estudios porque inhibir esta molécula puede tener efectos paradojales; lo que nosotros creemos es que se puede inhibir una de las zonas de esa molécula (hay dos); entonces hace falta profundizar un poco más el estudio”.

La investigación como inversión
Estudios recientes de Scott Johnson, especialista estadounidense en economía de la salud, estiman que un 20% de enlentecimiento en la progresión del Parkinson significaría un ahorro para el sistema de salud de Estados Unidos de 60.657 dólares por paciente.
“Nosotros siempre vemos la investigación como una inversión no como un gasto porque esta investigación a largo plazo tendría que poder disminuir los costos de los tratamientos y de la presión de esos costos sobre el sistema de salud; pero además también mejorar la calidad de vida de las personas y de las familias que están cuidando”, señaló Pitossi.
Casi 9 millones de afectados
Según la Organización Mundial de la Salud, 8,5 millones de personas en el mundo padecen la enfermedad de Parkinson, que afecta sobre todo a los mayores de 65 años. Es la segunda enfermedad neurodegenerativa más frecuente después del mal de Alzheimer. En la Argentina se estima que existen entre 70.000 a 100.000 pacientes afectados.
Según informó la Agencia CyTA Leloir, el primer estudio clínico de terapia celular para Parkinson se realizó hace 35 años y desde entonces se avanzó a paso lento.
En la actualidad hay tres ensayos para desarrollar terapias regenerativas que utilizan DA-CM como las que analizó el grupo de Pitossi: uno empezó en 2018 en Japón; otro en 2021 en los Estados Unidos; y otro este año, en Suecia y Gran Bretaña.
Del artículo publicado en PLos One también participaron Shirley Wenker, María Isabel Farías, Victoria Gradaschi, Corina García, María Celeste Leal y Carina Ferrari (por la Fundación Instituto Leloir-IIBBA Conicet), en colaboración con Xianmin Zeng, de RxCell (EE.UU.) y Juan Beauquis, del IBYME.
El trabajo fue posible gracias al financiamiento otorgado por la Agencia I+D+i, la Fundación René Barón y la International Society of Neurochemistry.